Aluminium ist nach Sauerstoff und Silizium das dritthäufigste Element der Erdrinde und an ihrem Aufbau mit ca. 8% beteiligt. Wegen seiner starken Neigung mit Nichtmetallen vor allem mit Sauerstoff zu reagieren, kommt es in der Natur nur in Verbindungen als Bestandteil vieler Mineralien vor.
Wegen der Sauerstoffaffinität ist es nicht möglich, Aluminium durch eine einfache Reduktion eines Oxids (wie es beispielweise bei der Gewinnung von Eisen der Fall ist) zu gewinnen. Allerdings kommt Aluminiumoxid in der Erdkruste nur selten vor und ist vor allem als Edelstein bekannt, je nach vorhandenen Spurenelementen als Rubin oder Saphir. Weitaus häufiger findet sich Aluminium in Form von Bauxit, das eine komplexe Zusammensetzung aufweist und bis zu 25 % Aluminium (je nach Herkunft) enthalten kann. Zusätzlich erschwert die Aluminiumgewinnung der Umstand, dass alle in der Natur vorkommenden und für die Aluminiumgewinnung geeigneten Rohstoffe auch Beimengungen solcher Elemente enthalten, die leichter zu reduzieren sind.
Verfahrensschritte bei der Gewinnung von Aluminium
Die Gewinnung von Aluminium ist aufwendig und besteht aus zwei großen und technologisch deutlich getrennten Schritten:
1) der Herstellung von reinem Aluminiumoxid aus dem Bauxit
2) der Elektrolyse des reinen Aluminiumoxids zu metallischem Aluminium
Eine Übersicht der Gewinnung ist in Abb. 1 dargestellt.
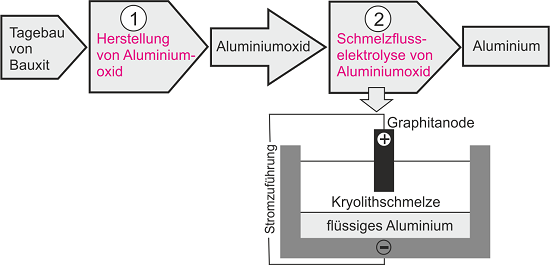
Abb. 1 Gewinnung von Aluminium - Übersicht (Grafik von Bozena Arnold)
Die Herstellung des metallischen Aluminiums erfolgt durch Reduktion des Aluminiumoxids Al2O3 auf elektrolytischem Wege in der Aluminiumhütte. Aluminiumoxid gehört zu den stabilsten chemischen Verbindungen. Seine einfache Reduktion zu Metall z.B. mit Kohlenstoff ist nicht anwendbar. Dafür muss die Methode der Elektrolyse eingesetzt werden. Dabei werden Aluminium-Ionen zu reinem Metall reduziert, das in flüssiger Form zurückbleibt und die Sauerstoff-Ionen zu Kohlenstoffoxiden oxidiert, die als Gase entweichen.
Der Schmelzpunkt des Aluminiumoxids liegt sehr hoch bei ca. 2060°C. Deswegen kann es nicht direkt als Schmelze elektrolysiert werden. Deswegen kann nur die Schmelzflusselektrolyse angewandt werden. Dabei wird als Elektrolyt eine Lösung von Aluminiumoxid in geschmolzenen künstlich hergestellten Kryolith verwendet. Kryolith ist ein Mineral aus Natrium, Aluminium und Fluor. Aus dem Zustandsdiagramm Aluminiumoxid-Kryolith ergibt sich, dass das am niedrigsten schmelzende (eutektische) Gemisch aus ca. 82% Kryolith und 18% Aluminiumoxid besteht und bei ca. 935°C schmilzt. Dementsprechend enthält die Schmelze für die Elektrolyse 15 … 20 % Aluminiumoxid und ihre Temperatur beträgt etwa 950°C. Die Dichte der Schmelze beträgt bei dieser Temperatur ca. 2,15 g/cm³, die des geschmolzenen Aluminiums ca.2,35 g/cm³, so dass das Metall sich unter der Schmelze sammelt und von der Rückoxidation durch den Luftsauerstoff geschützt wird. Die Schmelze befindet sich in einer mit Kohlenstoffmaterial ausgekleideten Eisenwanne, die als Kathode dient. In die Schmelze tauchen Anoden aus Kohle (Graphit) ein. Bei der Elektrolyse laufen folgende Vorgänge ab:
- Dissoziation des Al2O3 in der Schmelze:Al2O3 -> 2Al3+ + 3O2-
- Wandern der Ionen unter Wirkung der elektrischen Spannung: Kationen (Al3+) wandern zur Kathode, Anionen (O2-) wandern zur Anode.
- An der Anode geben die Sauerstoff-Ionen ab: 2O2-- 4e- -> O2
- Sauerstoff reagiert mit dem Kohlenstoff der Anode: 2O2 + 2C -> 2CO2. Kohlenstoffdioxid entweicht und der Kohlenstoff der Anode wird verbraucht.
- An der Kathode nehmen Aluminium-Ionen Elektronen auf: Al3+ + 3e- -> Al
Das entstehende Aluminium sinkt aufgrund seiner niedrigeren Dichte ab und sammelt sich am Boden der Elektrolysezelle.
Die Elektrolyse wird kontinuierlich betrieben, das entstehende Aluminium wird periodisch abgesaugt und Aluminiumoxid wird aus der Aufschüttung nachgeführt. Das so hergestellte Aluminium wird als Hüttenaluminium oder Primäraluminium bezeichnet. Der Reinheitsgrad des Hüttenaluminiums beträgt bis zu 99,5 %. Höhere Reinheitsgrade werden durch Raffination erreicht.
Hierbei werden Folgende Verfahren eingesetzt: Dreischichtenelektrolyse (Reinheitsgrad 99,99 %), Raffination über aluminiumorganische Komplexverbindungen (Reinheitsgrad 99,999 bis 99,9999 %), Zonenschmelzreinigung (Reinheitsgrad 99,99999 %).
Die Elektrolyse von Aluminiumoxid wird in der Elektrolysezelle mit Gleichstrom durchgeführt. Um zu einer guten Ausbeute zu kommen, müssen hohe Stromstärken von 100kA bis 280kA bei Zellspannungen von 4V bis 5V aufgewandt werden. In den Aluminiumhütten sind die einzelnen Zellen hintereinandergeschaltet, so dass Gesamtspannungen von über 1000V üblich sind. Der Energieeinsatz hat sich im Laufe der letzten Jahrzehnte von durchschnittlich 21 kWh Strom je Kilogramm Hüttenaluminium auf unter 15 kWh reduziert. Durch den Strombedarf ist die Aluminiumherstellung an Stromkosten gekoppelt, die in der Welt unterschiedlich sind.
Schmelzflusselektrolyse
Das Verfahren der Schmelzflusselektrolyse wurde gleichzeitig und voneinander unabhängig von dem Franzose Heroult und dem Amerikaner Hall im Februar des Jahres 1886 entdeckt. Es ist interessant, dass in allen Aluminiumhütten der Welt noch heute, viele Jahre später nach dem gleichen Verfahren von Heroult und Hall gearbeitet wird. Über 20 andere elektrolytische Wege blieben praktisch ohne Bedeutung. Das Hütten-Aluminium wird in einem Walzwerk zu Halbzeugen wie Blechen weiter verarbeitet.
Neben der Hüttenproduktion von Aluminium hat sich der Recyclingsektor zu einer gleichwertigen Rohstoffquelle entwickelt. Die Erzeugung von Aluminium aus Aluminiumschrott (Sekundäraluminium) erfordert nur etwa 5% der Energie, die für die Gewinnung von Aluminium aus Bauxit (Primäraluminium) erforderlich ist. Schätzungsweise befindet sich 70 % der jemals hergestellten Aluminiummenge nach wie vor im Gebrauch. <<





